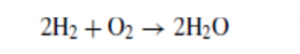PR Dossier 00014: verschil tussen versies
Geen bewerkingssamenvatting |
(tekst geplaatst) |
||
| Regel 26: | Regel 26: | ||
}} | }} | ||
In deze paragraaf richten we ons op de brandstofcel. Een andere manier van kijken naar de brandstofcel is om te zeggen dat de waterstof brandstof wordt ' verbrand ' in de eenvoudige reactie: | In deze paragraaf richten we ons op de brandstofcel. Een andere manier van kijken naar de brandstofcel is om te zeggen dat de waterstof brandstof wordt ' verbrand ' in de eenvoudige reactie: | ||
[[Bestand:Reactie FC.png|miniatuur]] | [[Bestand:Reactie FC.png|miniatuur]]Echter, in plaats van het vrijkomen van warmte-energie, wordt nu elektrische energie geproduceerd. | ||
Om deze reden zijn elektroden meestal plat (vlak of gebogen), met een dun laagje elektrolyt. De structuur van de elektrode is poreus, zodat het gas er doorheen kan dringen met maximaal contact tussen de elektrode, het elektrolyt en het gas. | |||
Om te begrijpen hoe de reactie tussen waterstof en zuurstof een elektrische stroom produceert, en waar de elektronen vandaan komen, moeten we de afzonderlijke reacties die bij elke elektrode plaatsvinden uitschrijven. | |||
In detail variëren deze voor verschillende types van brandstofcellen. | |||
We zullen echter beginnen met de eenvoudigste en nog steeds de meest voorkomende type: PEMFC | |||
Bij de anode van een PEMFC (Proton Exchange Membrane Fuel Cell) brandstofcel, ioniseren de waterstof gassen naar elektronen en H+ ionen. Bij deze reactie komt energie vrij. Bij de kathode reageert zuurstof met elektronen die uit de elektrode komen en de H<sup>+</sup> ionen die door het elektrolyt komen. Er ontstaat zo zuiver water. | |||
Om de reacties mogelijk te maken moet er een elektrisch circuit zijn van de anode naar de kathode waardoor de elektronen kunnen stromen. Daarnaast moeten de H<sup>+</sup> ionen door het elektrolyt gaan. Bijvoorbeeld een zuuroplossing met vrije H<sup>+</sup> ionen. Ditzelfde kan ook gerealiseerd worden met bepaalde polymeren waardoor de H<sup>+</sup> ionen zich kunnen bewegen. Deze polymeren noemen we ook wel het ''Proton-uitwisselings membraan (in het Engels “Proton Exchange Membrane”: PEM)'' | |||
[[Bestand:Afbeelding FC2 Nedstack.jpg|miniatuur|Samenstelling brandstofcel (bron Nedstack)]] | |||
[[Bestand:Afbeelding FC3 Nedstack.jpg|miniatuur|Opbouw stack (bron Nedstack)]] | |||
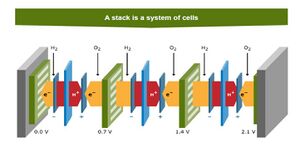
Elke brandstofcel bestaat uit een anode, kathode en MEA (Membrane Electrode Assembly). | |||
De brandstofcellen kunnen gestapeld worden tot een stack met tussen ieder cel een bipolaire plaat. Deze wordt tevens gebruikt voor de toe en afvoer van de reactie gassen (waterstof, zuurstof (in lucht) en waterdamp). | |||
Versie van 27 nov 2023 19:52
De basiswerking van de (waterstof) brandstofcel is eenvoudig. De eerste demonstratie van een brandstofcel werd door advocaat en wetenschapper William Grove in 1839, met behulp van een experiment gedaan. Bij elektrolyse wordt water gesplitst in waterstof en zuurstof door er een elektrische stroom doorheen te laten lopen. Bij een brandstofcel reageren waterstof en zuurstof weer naar water en nu komt er een elektrische stroom vrij. We kunnen dus elektrische energie opslaan in de waterstof en deze er op enig moment weer uithalen.
In deze paragraaf richten we ons op de brandstofcel. Een andere manier van kijken naar de brandstofcel is om te zeggen dat de waterstof brandstof wordt ' verbrand ' in de eenvoudige reactie:
Echter, in plaats van het vrijkomen van warmte-energie, wordt nu elektrische energie geproduceerd.
Om deze reden zijn elektroden meestal plat (vlak of gebogen), met een dun laagje elektrolyt. De structuur van de elektrode is poreus, zodat het gas er doorheen kan dringen met maximaal contact tussen de elektrode, het elektrolyt en het gas.
Om te begrijpen hoe de reactie tussen waterstof en zuurstof een elektrische stroom produceert, en waar de elektronen vandaan komen, moeten we de afzonderlijke reacties die bij elke elektrode plaatsvinden uitschrijven.
In detail variëren deze voor verschillende types van brandstofcellen.
We zullen echter beginnen met de eenvoudigste en nog steeds de meest voorkomende type: PEMFC
Bij de anode van een PEMFC (Proton Exchange Membrane Fuel Cell) brandstofcel, ioniseren de waterstof gassen naar elektronen en H+ ionen. Bij deze reactie komt energie vrij. Bij de kathode reageert zuurstof met elektronen die uit de elektrode komen en de H+ ionen die door het elektrolyt komen. Er ontstaat zo zuiver water.
Om de reacties mogelijk te maken moet er een elektrisch circuit zijn van de anode naar de kathode waardoor de elektronen kunnen stromen. Daarnaast moeten de H+ ionen door het elektrolyt gaan. Bijvoorbeeld een zuuroplossing met vrije H+ ionen. Ditzelfde kan ook gerealiseerd worden met bepaalde polymeren waardoor de H+ ionen zich kunnen bewegen. Deze polymeren noemen we ook wel het Proton-uitwisselings membraan (in het Engels “Proton Exchange Membrane”: PEM)
Elke brandstofcel bestaat uit een anode, kathode en MEA (Membrane Electrode Assembly).
De brandstofcellen kunnen gestapeld worden tot een stack met tussen ieder cel een bipolaire plaat. Deze wordt tevens gebruikt voor de toe en afvoer van de reactie gassen (waterstof, zuurstof (in lucht) en waterdamp).